
科目: 来源: 题型:选择题
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:解答题
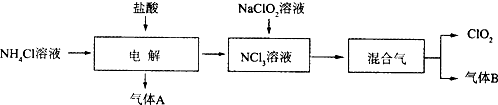
查看答案和解析>>
科目: 来源: 题型:解答题
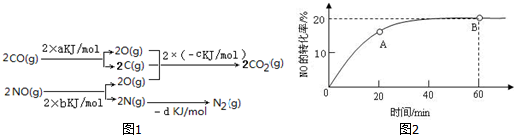
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl沉淀的生成和溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag +和Cl - | |
| C. | 升高温度,AgCl的溶解度不变 | |
| D. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度范围/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固体/g | 22.05 | 11.25 | 11.85 | 13.05 |
查看答案和解析>>
科目: 来源: 题型:解答题
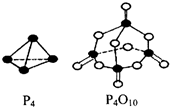 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.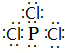 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com