
科目: 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | .亚硫酸钡溶于稀硝酸中:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向水玻璃中通入少量CO2:SiO32-+2CO2+3H2O═H4SiO4↓+2HCO3- | |
| D. | 用NaOH溶液吸收废气中的氮氧化物:NO+NO2+2OH-═2NO2-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
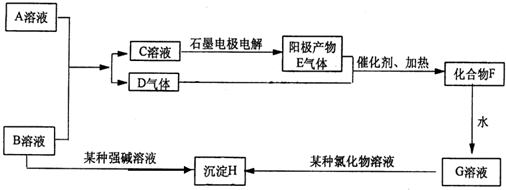
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:解答题
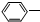 )
)
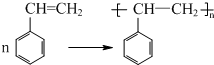 (不要求写出反应条件)
(不要求写出反应条件)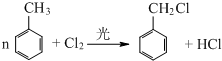 (要求写出反应条件)
(要求写出反应条件)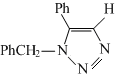 .
.查看答案和解析>>
科目: 来源: 题型:解答题
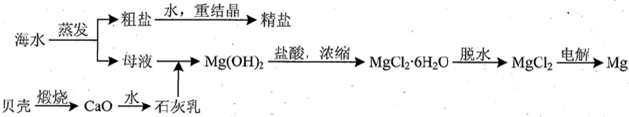
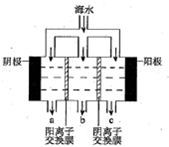 海水中主要离子的含量如下:
海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com