
科目: 来源: 题型:选择题
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为放热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是相同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
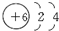 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:8 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
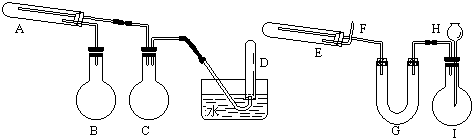
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
 1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )
1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示.老人为什么画这个结构式?它是 生命的前物质?它能合成吗?它有什么性质?不得而知.也许这是永远无法解开的谜;也许你有朝一日能解开它.某同学对此结构及性质有如下的推测,你认为不正确的是( )| A. | 它的分子式是C6N10H2O2 | |
| B. | 该物质最多可以有18个原子处于同一个平面上 | |
| C. | 它可以与别的物质发生加成反应 | |
| D. | 因其含氮量高,有可能作炸药 |
查看答案和解析>>
科目: 来源: 题型:解答题
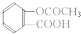

查看答案和解析>>
科目: 来源: 题型:解答题
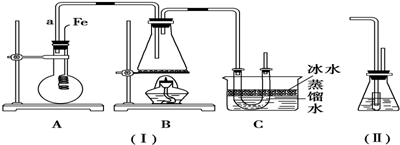
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com