
科目: 来源: 题型:解答题
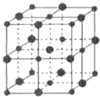 已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.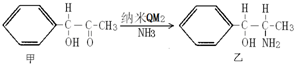
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
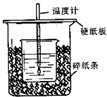 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
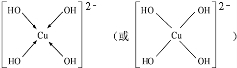
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CH2是还原剂,PbCl2是氧化剂 | B. | CuCl2是还原剂,O2是氧化剂 | ||
| C. | 乙烯是还原剂,O2是氧化剂 | D. | PbCl2和CuCl2都是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
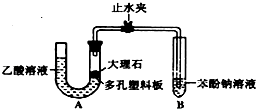 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.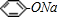 溶液
溶液查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用水润湿的pH试纸测量某溶液的pH | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1 H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1 H2SO4溶液 | |
| C. | 实验室用图①所示装置制取少量氨气 | |
| D. | 实验室用图②所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++SO32-+H2O | |
| B. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com