
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe、FeO和Fe2O3的混合物中加入过量的盐酸 | |
| B. | 等物质的量的 NaHCO3溶液与 Na2O2固体 | |
| C. | 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液 | |
| D. | 在NaBr溶液中通入过量氯气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用渗析的方法精制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | “钴酞菁”分子(直径为1.3×10-9米)在水中形成的分散系能产生丁达尔效应 | |
| D. | 冰醋酸、铝热剂、硫酸钡、SO2分别属于酸、混合物、强电解质、非电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目: 来源: 题型:解答题
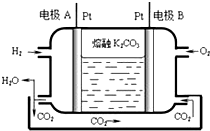 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
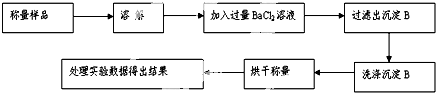
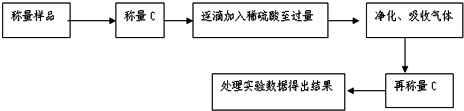

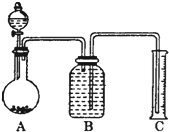
查看答案和解析>>
科目: 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题: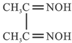 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com