
科目: 来源: 题型:解答题
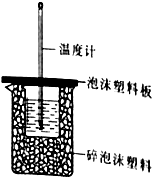 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目: 来源: 题型:解答题
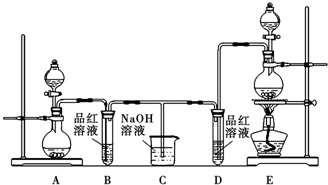
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下Cu与浓硫酸不反应,是因为发生了钝化 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 | |
| D. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
查看答案和解析>>
科目: 来源: 题型:解答题
 按要求填空:
按要求填空: ;
; ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 55 mol•g-1 | B. | 55 mol | C. | 55 g•mol-1 | D. | 55g |
查看答案和解析>>
科目: 来源: 题型:解答题
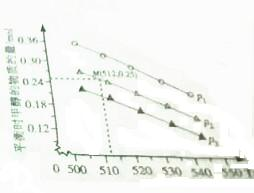 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
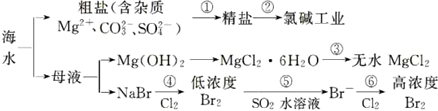
| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O真接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 | |
| D. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀间题 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子激之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com