
科目: 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
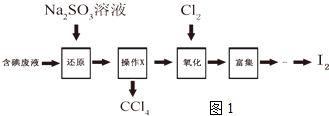
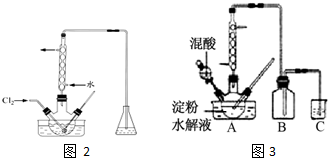
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 非电解质:乙醇、四氯化碳、氯气、葡萄糖 | |
| C. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
查看答案和解析>>
科目: 来源: 题型:选择题
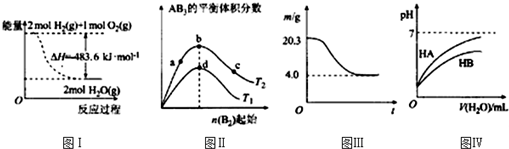
| A. | 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 图Ⅱ表示反应A2(g)+3B2(g)?2AB3(g),达到平衡时A2的转化率大小为:b>a>c | |
| C. | 图Ⅲ表示0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol•L-1 的AlCl3溶液中,含Al3+数小于NA | |
| B. | 标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| C. | 1mol NaBH4中含的离子的数目为6NA | |
| D. | 30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com