
科目: 来源: 题型:解答题
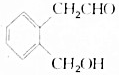 .A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题:
.A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题: .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$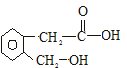 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
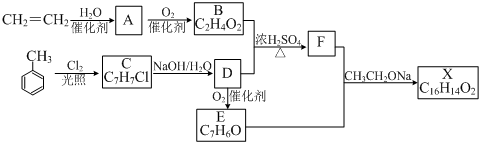
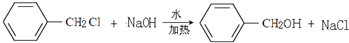 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.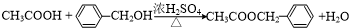 .
.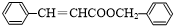 .
.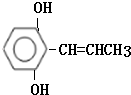 .
.查看答案和解析>>
科目: 来源: 题型:解答题
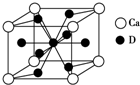 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
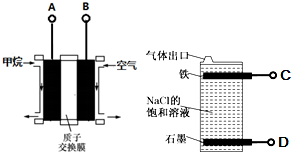
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | A电极的电极反应式为:CH4-8e-+2H2O=CO2+8H+ | |
| C. | 燃料电池工作时H+移向左边 | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数等于2NA | |
| D. | 1mol Fe 与足量的硝酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
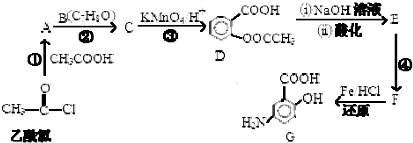
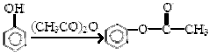 ,
, (具有还原性,极易被氧化)
(具有还原性,极易被氧化) .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)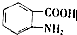 的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.查看答案和解析>>
科目: 来源: 题型:解答题
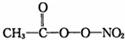 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目: 来源: 题型:解答题
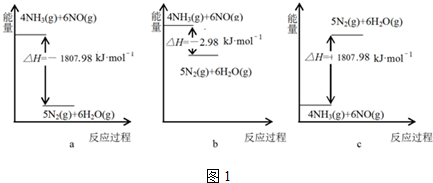
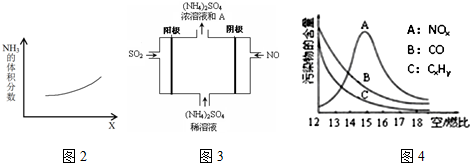
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com