
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
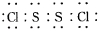 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
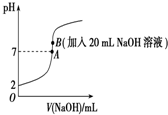 25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
25℃下,向20mL 0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
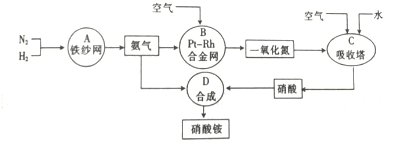
 近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施:
近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
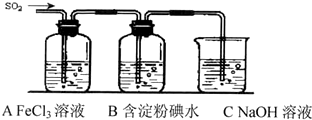
查看答案和解析>>
科目: 来源: 题型:解答题
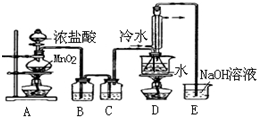
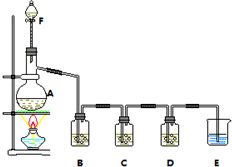 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com