
科目: 来源: 题型:解答题
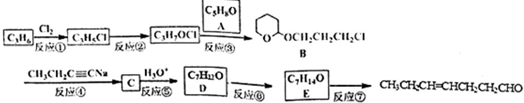
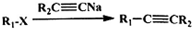
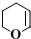 、CH3CH2C≡CCH2CH2CH2OH;
、CH3CH2C≡CCH2CH2CH2OH;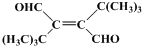 ;
;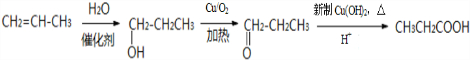 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径:Y<Z | |
| B. | 氢化物的稳定性:X>Y | |
| C. | 原子失电子能力:W<Z | |
| D. | X与Y形成的简单化合物为离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
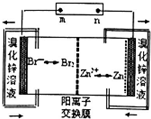
| A. | 充电时Zn2+通过阳离子交换膜由左侧流向右侧 | |
| B. | 放电时每转移2mol电子负极增重130g | |
| C. | 充电时阴极的电极反应式为Br2+2e-=2Br- | |
| D. | 若将电解液改为氯化锌溶液放电效果更好更安全 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 17g羟基和17gOH-含有的电子数均为10NA | |
| B. | 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L | |
| D. | 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目: 来源: 题型:选择题
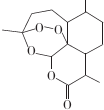
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可发生取代反应 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目: 来源: 题型:解答题
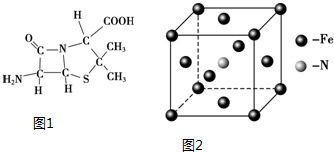
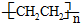 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2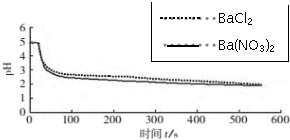 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com