
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
查看答案和解析>>
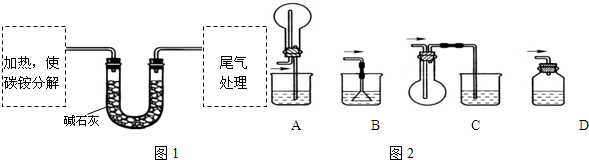
科目: 来源: 题型:解答题

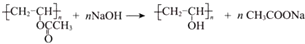
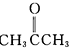 ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是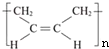 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 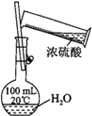 | 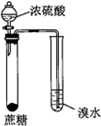 | 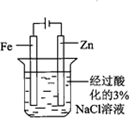 | 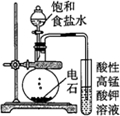 |
| 实验目的 | 配制一定物质的量浓度的硫酸 | 验证浓硫酸具有脱水性、氧化性 | 验证Fe电极被保护 | 用该装置制备并检验乙炔 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 标准状况下的2.24 LM溶于水,所得溶液pH=13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | 一定条件下,Cu可与W的最高价氧化物对应水化物发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 烃与卤素单质之间的反应均为加成反应 | |
| C. | 多糖、油脂均可发生水解反应 | |
| D. | 石油分馏和裂化均为物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: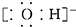 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com