
科目: 来源: 题型:选择题
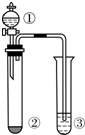 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 水 | 电石 | CuSO4溶液 | 乙炔具有还原性 |
| B | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| C | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | 溶解度:AgCl>Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
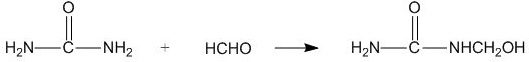
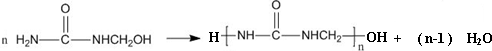
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 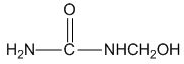 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
查看答案和解析>>
科目: 来源: 题型:选择题
 、
、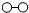 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 密度:Na>K | B. | 稳定性:HCl>HBr | C. | 还原性:I?>Br? | D. | 碱性:KOH>NaOH |
查看答案和解析>>
科目: 来源: 题型:解答题


 .
.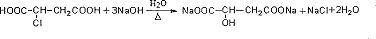 .
. 等.(任写一种)
等.(任写一种)查看答案和解析>>
科目: 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目: 来源: 题型:解答题
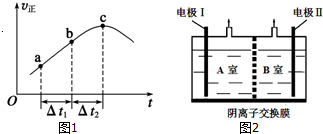
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com