
科目: 来源: 题型:选择题

| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 每个青蒿素分子中含有4个六元环 | |
| C. | 异胡薄荷醇可发生消去反应、加成反应 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
. 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目: 来源: 题型:解答题

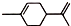 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为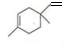 .
.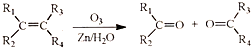 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)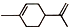 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式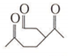 .
.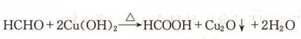 .
.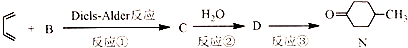
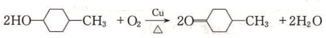 .
.查看答案和解析>>
科目: 来源: 题型:解答题

 ,属于弱电解质的是H2O、Al(OH)3.
,属于弱电解质的是H2O、Al(OH)3.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 通入1molCl2:2Fe2++2Br-+2Cl2→4Cl-+Br2+2Fe3+ | |
| B. | 通入足量Cl2:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl- | |
| C. | 加入含2molBa(OH)2的溶液:Al3++SO42-+Ba2++4OH-→BaSO4↓+AlO2-+2H2O | |
| D. | 加入足量Ba(OH)2的溶液:Fe2++Al3++SO42-+Ba2++6OH-→Fe(OH)2↓+AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 操作 | 现象 | 结论 |
| A | 甲醛溶液 | 加紫色石蕊溶液 | 变红 | 变质 |
| B | 亚硫酸钠溶液 | 加BaCl2 | 产生白色沉淀 | 变质 |
| C | 铁粉 | 加KSCN | 未变血红色 | 未变质 |
| D | 过氧化钠固体 | 加足量水 | 产生使带火星木条复燃的气体 | 未变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 通入少量SO2,溶液漂白性增强 | |
| B. | 加入少量NaHCO3固体,c(ClO)减小 | |
| C. | 加入少量水,水的电离平衡向正方向移动 | |
| D. | 加入NaOH固体至恰好完全反应,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目: 来源: 题型:选择题
 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com