
科目: 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目: 来源: 题型:填空题
 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液一定显酸性 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,正极反应式为Cn[AlCl4]+e-═[AlCl4]-+Cn | |
| B. | 充电时,阴极反应式为4[Al2Cl7]-3e-═Al+7[AlCl4]- | |
| C. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| D. | 充、放电过程中,R+的移动方向相反 |
查看答案和解析>>
科目: 来源: 题型:选择题
 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 古代发明 | 化学变化 |
| A | 生产陶瓷 | SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
| B | 黑火药爆炸 | S+2KNO3+3C$\frac{\underline{\;点燃\;}}{\;}$K2S+N2↑+3CO2↑ |
| C | 湿法炼铜 | CuSO4+Fe═Cu+FeSO4 |
| D | 用谷物酿酒 | (C6H10O5)n→C6H12O6→CH3CH2OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题



 ;
; ;
;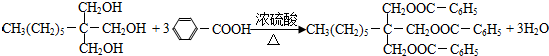 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com