
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 实验操作 | 实验现象与结论 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
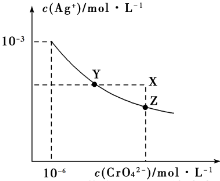
| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).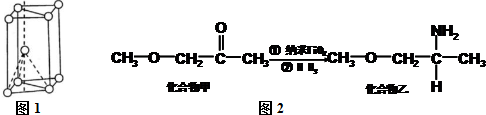

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未用NaOH溶液润洗 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
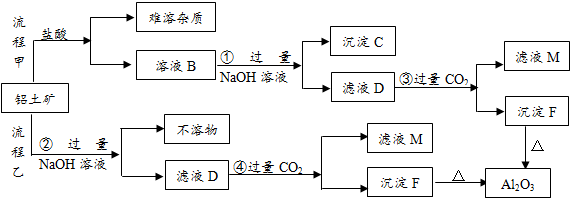
查看答案和解析>>
科目: 来源: 题型:解答题
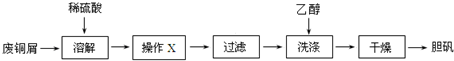
查看答案和解析>>
科目: 来源: 题型:解答题
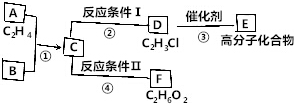 已知:
已知: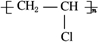 ,FCH2OHCH2OH.
,FCH2OHCH2OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com