
科目: 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 金属性:Na>Mg>Ca |
查看答案和解析>>
科目: 来源: 题型:解答题
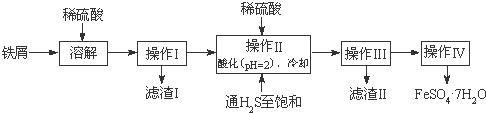
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目: 来源: 题型:解答题
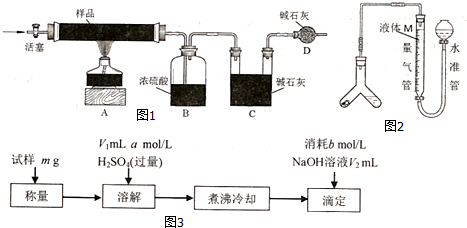
查看答案和解析>>
科目: 来源: 题型:解答题
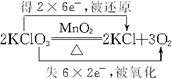 .
.
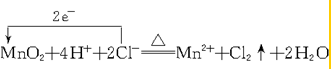 .
.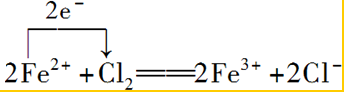 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目: 来源: 题型:解答题
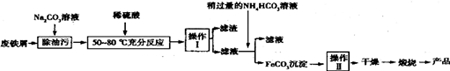
 HCO3-+OH-;
HCO3-+OH-;查看答案和解析>>
科目: 来源: 题型:解答题
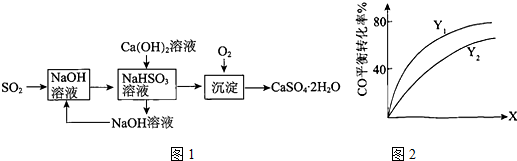
查看答案和解析>>
科目: 来源: 题型:选择题
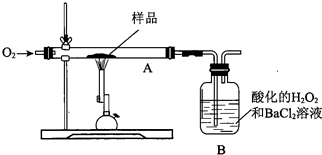
| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CCl4和SiCl4的熔点 | |
| B. | 邻羟基苯甲醛( )和对羟基苯甲醛( )和对羟基苯甲醛(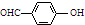 )的沸点 )的沸点 | |
| C. | HF和HCl在水中的溶解度 | |
| D. | H2SO3和H2SO4的酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com