
科目: 来源: 题型:选择题
| A. | 实验室可用浓硫酸干燥SO2气体 | |
| B. | 准确量取25.00 mL的液体可选用量筒或滴定管等量具 | |
| C. | 无色气体燃烧后生成的气体通入Ba(OH)2溶液,有白色沉淀生成,则原气体一定是CO | |
| D. | FeCl3、CuCl2的混合液中加铁粉充分反应后仍有固体存在,再加KSCN溶液可呈现血红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
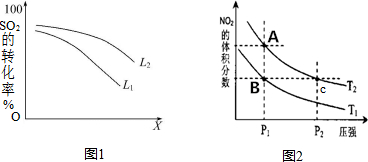
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
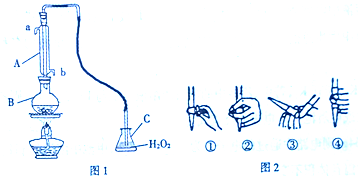
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若容积为某一固定值,当体系的压强不再发生变化时说明达到化学平衡状态 | |
| B. | 若上述可逆反应达化学平衡状态后,给平衡体系加压(缩小容积,其他条件不变),则容器内气体的平均摩尔质量将减小 | |
| C. | 若上述可逆反应达到化学平衡状态后,升高温度(其他条件不变)体系颜色加深,则Q>0 | |
| D. | 对于上述可逆过程给平衡体系减压(增大容积,其他条件不变),可以提高N2O4的产率 |
查看答案和解析>>
科目: 来源: 题型:选择题
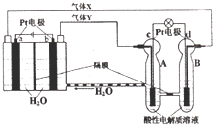
| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com