
科目: 来源: 题型:解答题
 短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子.
短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子.查看答案和解析>>
科目: 来源: 题型:解答题
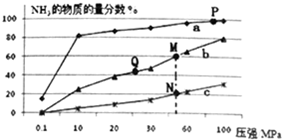 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目: 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | O2中只存在非极性共价键,SO2是共价化合物 | |
| B. | 氧化剂是O2,还原产物只有Fe2O3 | |
| C. | 每消耗22.4LO2,即转移4NA个电子 | |
| D. | SO2溶于水之后的溶液可以导电,所以SO2是电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 已知N2和H2在一定条件下发生下列可逆反应:
已知N2和H2在一定条件下发生下列可逆反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向1mol•L-1的氨水中加少里硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 物质的量浓度相等的①(NH4)2SO4溶液②NH4HCO3溶液③NH4Cl溶液④(NH4)2Fe(SO4)2溶液液中,c(NH${\;}_{4}^{+}$)的大小关系:④>①>③>② | |
| C. | 将2mol•L-1的某一元酸HA溶液和1mol•L-1 NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(HA) | |
| D. | 物质的量浓度之比为 1:1 的NaClO、NaHCO3混合溶液中:c(HC10)+c(ClO-)=c(C0${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com