
科目: 来源: 题型:选择题
| A. | 0.75 L | B. | 0.336 L | C. | 1.5 L | D. | 0.448 L |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
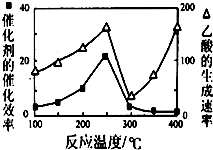 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目: 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
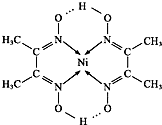
查看答案和解析>>
科目: 来源: 题型:解答题
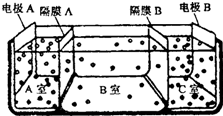
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

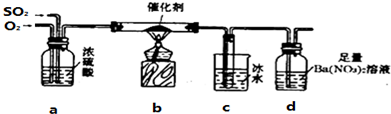

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com