
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
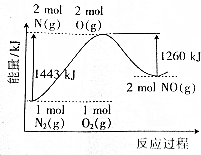
| A. | 氮气和氧气的反应是氧化还原反应,也是放热反应 | |
| B. | 1molNO分子被拆成原子要放出630kJ能量 | |
| C. | 1molN2(g)和1molO2(g)完全反应生成2molNO(g)时吸收183kJ能量 | |
| D. | 在酒精灯加热条件下,N2和O2能发生化合反应生成NO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 低QkJ | B. | 低2QkJ | C. | 高QkJ | D. | 高2QkJ |
查看答案和解析>>
科目: 来源: 题型:解答题
 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
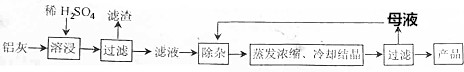
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com