
科目: 来源: 题型:选择题
| A. | H2+Cl2═2HCl | B. | CuO+2H+═Cu2++H2O | ||
| C. | H2O+CaO═Ca(OH)2 | D. | NaOH+HCl═H2O+NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 铜及其化合物在科学研究和工业生产中具有许多用途.
铜及其化合物在科学研究和工业生产中具有许多用途. ;
;查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
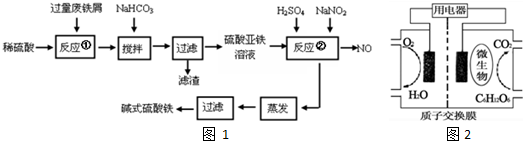
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
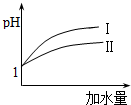 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com