
科目: 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D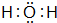 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子数目为0.4NA | |
| C. | 1 L 1 mol?•L-1 FeCl3完全水解生成NA个胶体粒子 | |
| D. | 含2 mol H2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
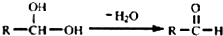

 .
. ;
; .
. (只写出一种即可)
(只写出一种即可)查看答案和解析>>
科目: 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应:
查看答案和解析>>
科目: 来源: 题型:解答题
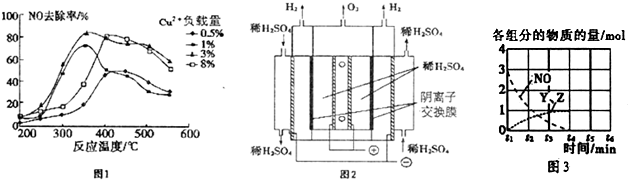
查看答案和解析>>
科目: 来源: 题型:解答题
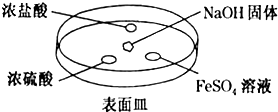
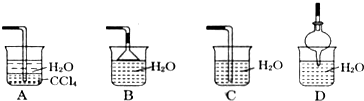

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com