
科目: 来源: 题型:解答题
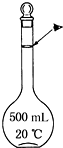 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 滴定时,装未知浓度的NaOH溶液锥形瓶忘记用NaOH溶液润洗 | |
| B. | 酸式滴定管用蒸馏水洗后,忘记用盐酸润洗 | |
| C. | 滴定前,滴定管的尖嘴处有气泡,而在滴定后气泡消失 | |
| D. | 滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com