
科目: 来源: 题型:解答题

| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
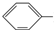 X+CH2=CH-M$→_{碱}^{Pb}$
X+CH2=CH-M$→_{碱}^{Pb}$ CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
CH═CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等)
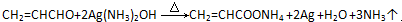 .
. .
.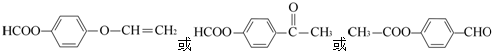 .
. )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(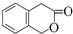 )需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,
)需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液,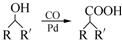 (R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2=CH-CH3)为原料,合成 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{Na_{3}CH_{2}Br溶液}$CH3CH2OH.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgI悬浊液中存在平衡:AgI(s)?Ag+(aq)+I-(aq) | |
| B. | 25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变 | |
| C. | 向含KCl、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀 | |
| D. | 用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸碱中和滴定终点的pH值一定等于7 | |
| B. | 滴定实验中锥形瓶不可用待测液润洗 | |
| C. | 滴定实验中,KMnO4溶液应放在碱式滴定管中 | |
| D. | 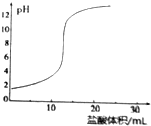 用盐酸滴定NaOH溶液的滴定曲线如图所示 |
查看答案和解析>>
科目: 来源: 题型:解答题
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 | |
| B. | 100mL1mol•L-1的盐酸和50mL2mol•L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 | |
| C. | 100mLpH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 | |
| D. | 100mLpH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com