
科目: 来源: 题型:选择题
| A. | 25℃时,由水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、NH4+、I-、NO3- | |
| B. | 能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- | |
| C. | NaHCO3溶液中:K+、Na+、SO42-、Al3+ | |
| D. | 常温下,c(H+)/c(OH-)=1×1012的溶液中:Fe2+、Mg2+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤⑥ | C. | 全部 | D. | ①②④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用广泛pH试纸测得Na2CO3溶液的pH为10.5 | |
| B. | 用10mL量筒量取5.20mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用25mL的酸式滴定管量取14.80mL KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
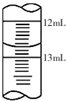 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):查看答案和解析>>
科目: 来源: 题型:解答题
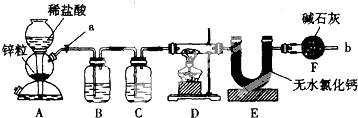
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com