
科目: 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨转化为金刚石是一个物理变化 | D. | 石墨和金刚石是同一种物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚2-甲基-1-丙烯可以通过加聚反应制得 | |
| B. | 聚2-甲基-1-丙烯的分子式为 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃烧生成CO2和H2O的物质的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
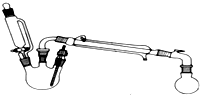 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)+c(NH4+)=2c(OH-) | |
| B. | 由H2O电离出的c(H+)=1.0×10-12mol•L-1 | |
| C. | 与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3•H2O)=0.02 mol•L-1 | |
| D. | 与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3•H2O)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
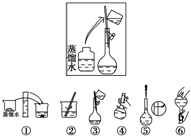 某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )
某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )| A. | ①与②之间 | B. | ②与③之间 | C. | ④与⑤之间 | D. | ⑤与⑥之间 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
查看答案和解析>>
科目: 来源: 题型:解答题
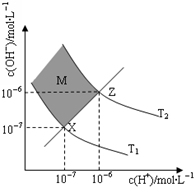 醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com