
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| C. | 用NaOH溶液滴定醋酸溶液时,不宜选用甲基橙作指示剂 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z、Y、X、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | 若X?Y?W组成的简单离子电子层结构相同,则W离子半径最大. |
查看答案和解析>>
科目: 来源: 题型:选择题
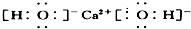
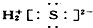

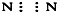

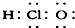
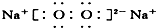
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
查看答案和解析>>
科目: 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| D. | 甲烷在空气中燃烧的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子 数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:X>Y>Z>W | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com