
科目: 来源: 题型:解答题
 (1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
(1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.查看答案和解析>>
科目: 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
关于等质量的SO2和SO3的比较,正确的是
A.所含氧原子的个数比为2:3 B.所含硫原子的个数比为1:1
C.所含硫元素的质量比为5:4 D.所含原子个数比为3:4
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充分反应后放出热量为Q | |
| B. | 增大压强,平衡右移,Q值变大 | |
| C. | 若生成1molSO3(s),放出热量大于$\frac{Q}{2}$ | |
| D. | 使用催化剂,改变反应途径,Q值也随之改变 |
查看答案和解析>>
科目: 来源: 题型:解答题
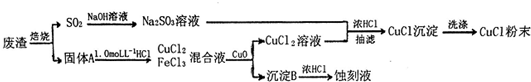
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.44g CO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L四氯化碳含有的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始物质的量/mol | 2 | 4 | 0 |
| 4 min末物质的量/ihol | 1.6 | 2.8 | a |
| 平衡物质的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃该反应的平衡常数为4 | |
| C. | 前4min内,用Z的变化量表示的平均反应速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的体系温度,V逆:增大,V正增大,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com