
科目: 来源: 题型:选择题
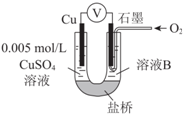
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用,其原理如图所示.下列说法正确的是( )| A. | 石墨电极上发生氧化反应 | |
| B. | 根据图示,物质A为CO2 | |
| C. | 甲烷燃料电池中CO32-向空气一极移动 | |
| D. | 为增强污水的导电能力,可向污水中加入适量乙醇 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某小组同学利用原电池装置探究物质的性质.
某小组同学利用原电池装置探究物质的性质.| 装置 | 编号 | 电极A | 溶液B | 操作及现象 |
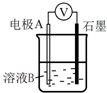 | Ⅰ | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
| 编号 | 溶液B | 操作及现象 |
| Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
| Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
| Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
查看答案和解析>>
科目: 来源: 题型:解答题
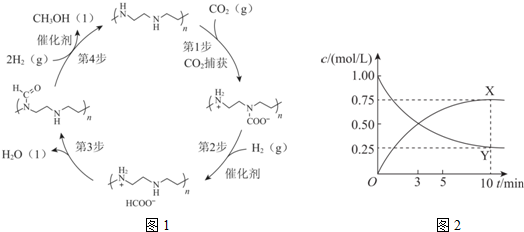
查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |

查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 共价化合物中只含有共价键 | |
| C. | 一个阳离子只可与一个阴离子之间存在离子键 | |
| D. | 金属元素和非金属元素化合一定形成离子键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NCl3分子是非极性分子 | |
| B. | 分子中的所有原于均达到8电子稳定结构 | |
| C. | NBr3的熔点比NCl3的熔点低 | |
| D. | 分子中N-C1键键长比CCl4分子中C-C1键键长长 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com