
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| C. | 常温下2S2O(g)═3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
查看答案和解析>>
科目: 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1××10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-15 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在CH3COONa溶液中通入SO2,生成CH3COOH | |
| B. | 等浓度的盐酸、CH3COOH溶液分别和锌反应,开始时盐酸的反应速率快 | |
| C. | 常温下0.1 mol•L-1 CH3COOH溶液的pH=2.1 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大 | |
| B. | 电离平衡常数(K)与温度无关 | |
| C. | 不同浓度的同一弱电解质,其电离平衡常数(K)不同 | |
| D. | 多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
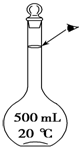 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
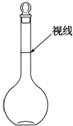 实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com