
科目: 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1 mol/L盐酸③0.1 mol/L氯化镁溶液 ④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,沉淀变为红褐色,说明溶解度Mg(OH)2>Fe(OH)3 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mo-l,逆反应的活化能为Eb kJ•mol-l,则△H=-( Ea-Eb)kJ.mol-l | |
| B. | 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
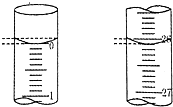 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锥形瓶洗净后还留有蒸馏水 | |
| B. | 取碱液的滴定管开始有气泡,放出液体后气泡消失 | |
| C. | 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化 | |
| D. | 用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com