
科目: 来源: 题型:选择题
| A. | 2SO2+O2=2SO3△H=-196.6 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ | D. | C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该元素在元素周期表中一定处于ⅦA族 | |
| B. | 该元素可能是氟元素 | |
| C. | 该元素的某种化合物可能具有漂白性 | |
| D. | 该元素的单质一定是非金属 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
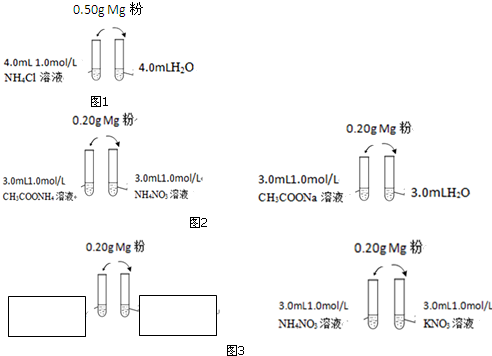
查看答案和解析>>
科目: 来源: 题型:解答题
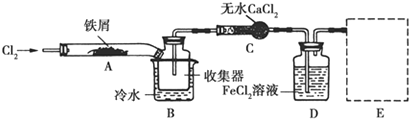
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用pH试纸检测,氨水溶液呈碱性:NH3•H2O=NH4++OH- | |
| B. | 100℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13 H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | FeCl3溶液中通入适量SO2,溶液黄色褪去:Fe3++SO2+2H2O=Fe2++SO42-+4H+ | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目: 来源: 题型:多选题
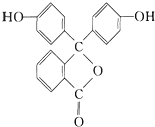
| A. | 酚酞具有弱酸性,且属于芳香族化合物 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A.用氧化铁作外墙涂料 | B.铸造司母戊鼎 | C.火法炼铜 | D.淘金制饰品 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
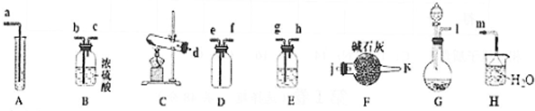
| 装置编号 | |||
| 装置中的试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com