
科目: 来源: 题型:解答题
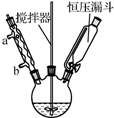 以香豆素3甲酸乙酯(
以香豆素3甲酸乙酯(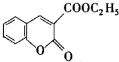 )为原料合成香豆素3甲酸(
)为原料合成香豆素3甲酸(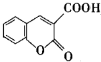 )的装置如图所示,实验步骤如下:
)的装置如图所示,实验步骤如下: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$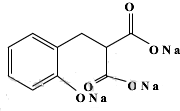 +C2H5OH+H2O.
+C2H5OH+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
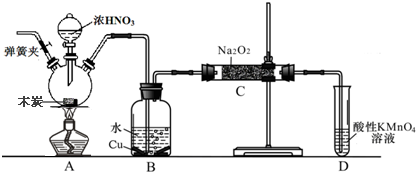
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | 4NH3+6NO═5N2+6H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgNO3溶液中滴入少量的Na2S溶液 2Ag NO3+S2-=Ag2S↓+2NO3- | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHCO3溶液 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
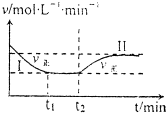 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡的标志:气体密度不再发生变化 | |
| D. | t2时刻改变的条件可以是向密闭容器中加H2和N2混合气 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+):c(NH3•H2O)始终减小 | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com