
科目: 来源: 题型:选择题
| A. | ①⑥ | B. | ③⑤ | C. | ④⑥⑦ | D. | ②⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
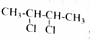 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: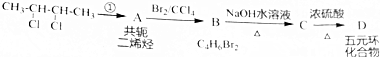
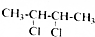 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.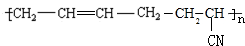 等.
等.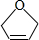 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲、乙中CO的体积分数相同 | |
| B. | 达到平衡时,甲用时间比乙短 | |
| C. | 甲中CO2的转化率比乙高 | |
| D. | 若甲、乙中都再充入同量的氦气,平衡均不移动 |
查看答案和解析>>
科目: 来源: 题型:填空题
 N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).
N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).查看答案和解析>>
科目: 来源: 题型:选择题
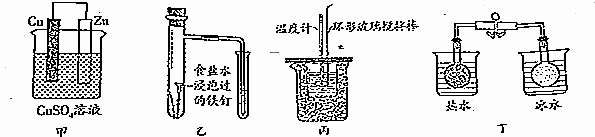
| A. | 图甲所示的实验:根据溶液颜色变化可比较Zn、Cu的金属活动性 | |
| B. | 图乙所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 | |
| C. | 图丙所示的实验:根据温度计读数的变化用浓硫酸和Na0H反应测定中和热 | |
| D. | 图丁所示的实验:根据两烧瓶中气体颜色的变化判断2N02(g)?N20(g)是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(O2)=0.15mol•L-1•min-1 | ||
| C. | v(NO)=0.2mol•L-1•min-1 | D. | v(H2O)=0.25mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com