
科目: 来源: 题型:解答题
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
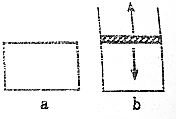 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用Na2CO3溶液处理水垢中的不溶物:CaSO4(s)+CO${\;}_{3}^{2-}$(aq)=CaCO3(s)+SO${\;}_{4}^{2-}$ | |
| B. | 将Na2S溶液在空气中长期放置变浑浊:2S2-+O2+4H+=2S+2H2O | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-=CaCO3↓+2H2O | |
| D. | 向Fe(NO3)3溶液中通入过量SO2:2Fe3++SO2+2H2O=2Fe2++SO${\;}_{4}^{2-}$+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com