
科目: 来源: 题型:选择题
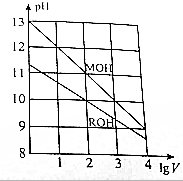 常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )
常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )| A. | MOH是强碱,ROH是弱碱 | |
| B. | 原ROH溶液的浓度为1.0mol/L | |
| C. | 常温下,ROH的电离平衡常数Kb约为1.1×10-5 | |
| D. | 当1gV=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}<10$ |
查看答案和解析>>
科目: 来源: 题型:解答题
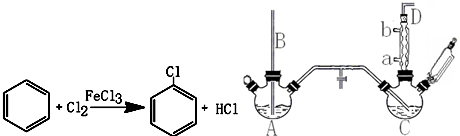
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
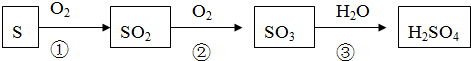
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
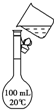 用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:
用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:查看答案和解析>>
科目: 来源: 题型:多选题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | B元素不能形成共价化合物 | |
| B. | 离子半径大小A+>D2- | |
| C. | A和E形成的化合物中只可能含离子键 | |
| D. | B和E的化合物不能溶于氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
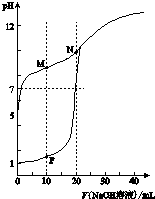 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
查看答案和解析>>
科目: 来源: 题型:选择题
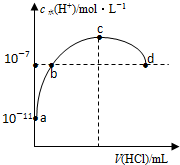
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com