
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
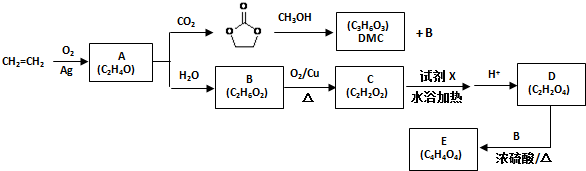
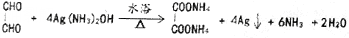 .
.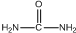 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式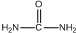 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$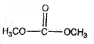 +2NH3↑.
+2NH3↑.查看答案和解析>>
科目: 来源: 题型:解答题
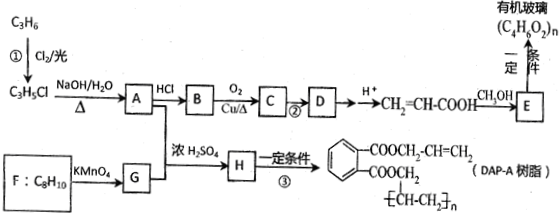
 ;
;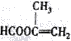 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
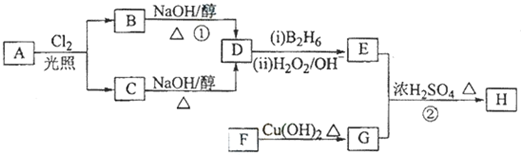
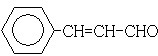 ;
;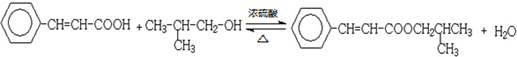 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与氢氧化钠反应的氯气一定为0.16 mol | |
| B. | n(Na+):n(Cl-)可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合溶液呈中性 | |
| B. | a≥b | |
| C. | 混合溶液中,c(A-)=c(Na+) | |
| D. | 混合液中水电离出c(OH-)大于该温度下纯水电离出c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
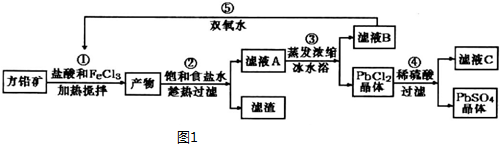
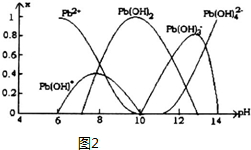
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目: 来源: 题型:选择题
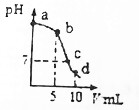 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
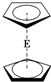 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为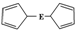 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com