
科目: 来源: 题型:解答题
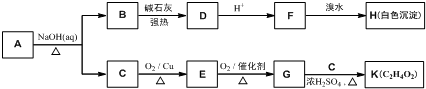

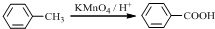
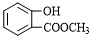 .
.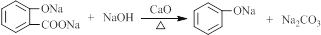 .
.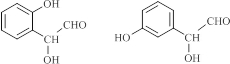 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:解答题
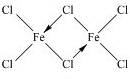 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).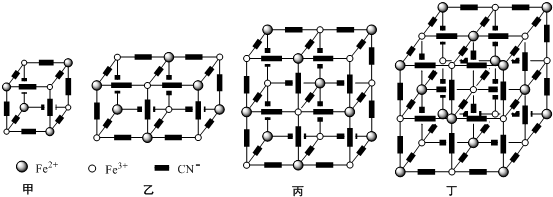
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
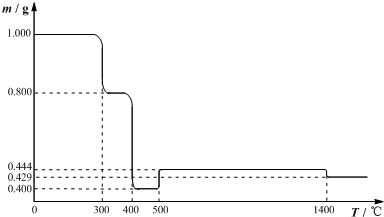
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
查看答案和解析>>
科目: 来源: 题型:选择题
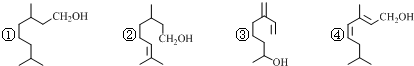
| A. | ①③④互为同分异构体 | |
| B. | ②③④互为同系物 | |
| C. | 上述四种物质中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物质分别与足量H2发生加成反应,共可得2种产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% |
查看答案和解析>>
科目: 来源: 题型:解答题
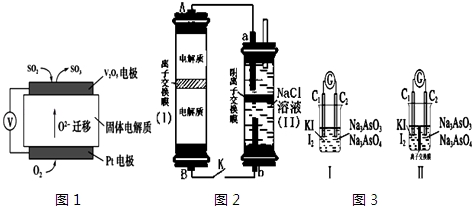
查看答案和解析>>
科目: 来源: 题型:解答题
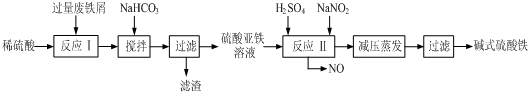
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com