
科目: 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(取代反应) | |
| B. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH(加成反应) | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O(取代反应) | |
| D. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O(加成反应) |
查看答案和解析>>
科目: 来源: 题型:解答题
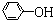 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子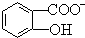 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是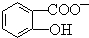 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为H2O2和Na2O2都是过氧化物,所以二者化学键的类型完全相同 | |
| B. | 标准状况下,2.24 L NO2和N2O4组成的混合气体中,原子总数是分子总数的3倍 | |
| C. | NO、NO2、SO2、SO3都是酸性氧化物 | |
| D. | 常温常压下,5.6 L SO2与足量的O2混合,充分反应后,生成的SO3物质的量小于0.25 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
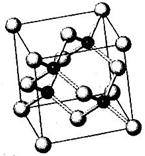 N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:
N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com