
科目: 来源: 题型:选择题
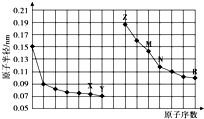
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
查看答案和解析>>
科目: 来源: 题型:选择题
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
查看答案和解析>>
科目: 来源: 题型:解答题

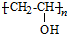 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.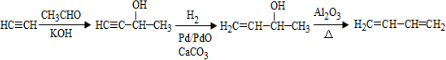 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.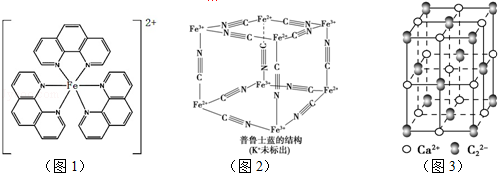
 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.查看答案和解析>>
科目: 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
科目: 来源: 题型:解答题
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目: 来源: 题型:解答题
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com