
科目: 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | 在船底镶嵌锌块和将船体与电源负极相连,二者防腐的方法都称为牺牲阳极的阴极保护法 | |
| C. | 1 mol葡萄糖水解能生成2mol CH3CH2OH和2mol CO2 | |
| D. | 不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
查看答案和解析>>
科目: 来源: 题型:解答题
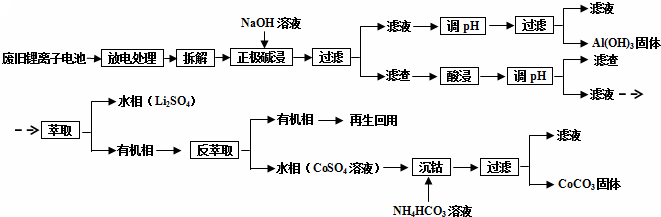
查看答案和解析>>
科目: 来源: 题型:解答题
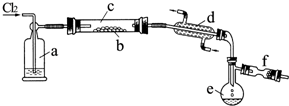 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).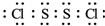 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
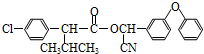 )
)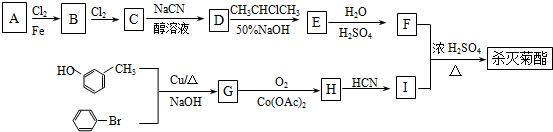
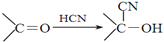
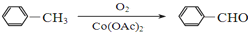
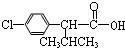 +
+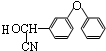 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$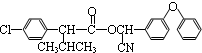 +H2O.
+H2O.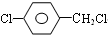 +3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+
+3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+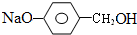 .
.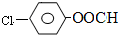 结构,则符合此条件的F共有8种.
结构,则符合此条件的F共有8种.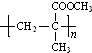 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).查看答案和解析>>
科目: 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:解答题
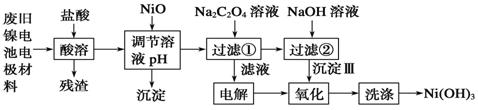
查看答案和解析>>
科目: 来源: 题型:选择题
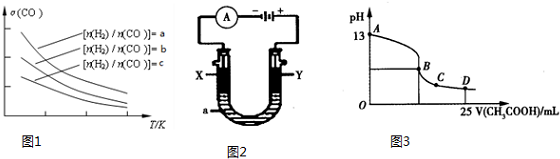
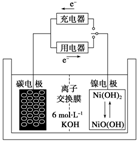 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向碳电极 | |
| B. | 放电时离子交换膜每通过4mol离子,碳电极质量减少12g | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将镍电极与电源的负极相连 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大量共存 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol/LCH3COONa溶液的pH | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱 |
| D | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com