
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
查看答案和解析>>
科目: 来源: 题型:选择题
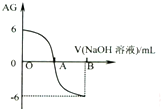 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气与明矾处理水的原理完全相同 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
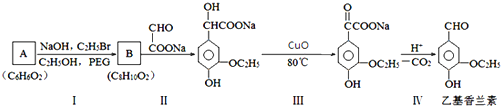
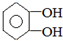 .
.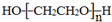 .若PEG的平均相对分子质量为17618,则其平均聚合度约为400.
.若PEG的平均相对分子质量为17618,则其平均聚合度约为400. .
.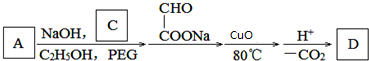
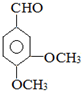 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com