
科目: 来源: 题型:选择题
| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目: 来源: 题型:解答题
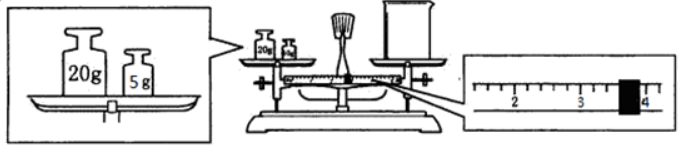
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=b=100 | B. | a=b=1000 | C. | a<b | D. | a>b |
查看答案和解析>>
科目: 来源: 题型:选择题
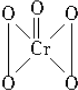
| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
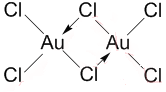 .
.查看答案和解析>>
科目: 来源: 题型:解答题
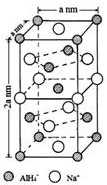 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.  .
. 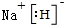 .
.  (标明配位键).
(标明配位键). 查看答案和解析>>
科目: 来源: 题型:解答题
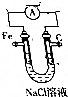 生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.
生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中含氧量较多,燃烧过程电会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀.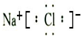 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com