
科目: 来源: 题型:解答题
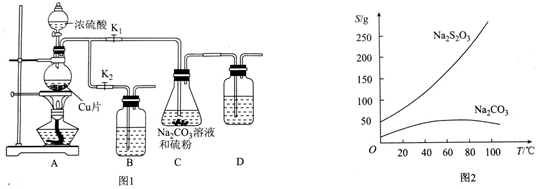
查看答案和解析>>
科目: 来源: 题型:解答题
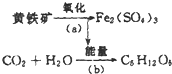 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目: 来源: 题型:填空题
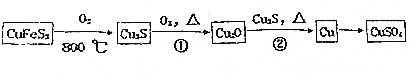
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N+2)}{A}$ mol | C. | $\frac{m(A-N-2)}{A}$ mol | D. | $\frac{m(A+N-2)}{A}$ mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目: 来源: 题型:解答题
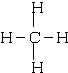 B.乙烯
B.乙烯
 2NH3
2NH3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com