
科目: 来源: 题型:解答题
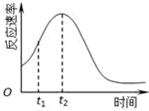 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室需要0.1mol•L-1NaOH溶液480mL.
实验室需要0.1mol•L-1NaOH溶液480mL.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能用适当的酸碱指示剂来判断 | |
| B. | 参加反应的酸中的H+离子总量和碱中OH-离子总量相等 | |
| C. | 反应混合液的pH=7 | |
| D. | 反应的热效应即为中和热 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
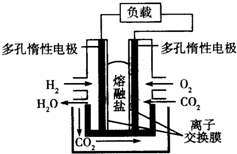
| A. | CO2在电池反应过程中不参与反应 | |
| B. | 电池总反应为2H2O═O2↑+2H2↑ | |
| C. | 该离子交换膜为阳离子交换膜 | |
| D. | 电池正极反应式为O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用容量瓶前需检查它是否漏水 | |
| B. | 将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切 | |
| C. | 配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线 | |
| D. | 定容后盖好瓶塞,反复上下颠倒,摇匀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 称量碳酸钠晶体(Na2CO3•10H2O)的时间太长,而且暴露在空气中 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时仰视刻度线 | |
| D. | 溶解后未冷却到室温,立即转移到容量瓶中 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com