
科目: 来源: 题型:解答题
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 往待测液中滴加硝酸银溶液 | 有白色沉淀出现 | 待测液中含有Cl- |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中氧化剂和还原剂的质量比为1:2 | |
| B. | 反应中生成了8g Cu2S | |
| C. | 反应中有0.2×6.02×1023个电子转移 | |
| D. | 反应中有1.6g硫被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海带 | B. | 食盐 | C. | 面粉 | D. | 酸奶 |
查看答案和解析>>
科目: 来源: 题型:解答题
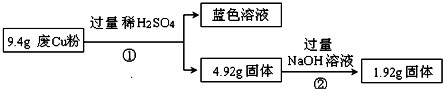
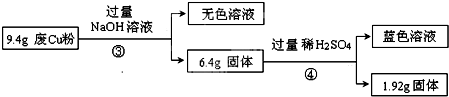
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com