
科目: 来源: 题型:解答题
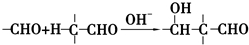
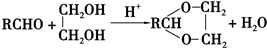
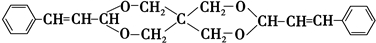
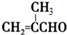 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$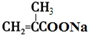 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.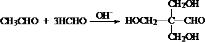 .
.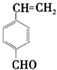 和
和 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
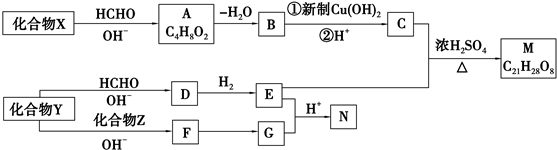
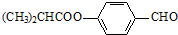 .合成M的一种途径如下:
.合成M的一种途径如下:
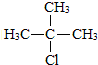 ,D中官能团的名称是羧基.
,D中官能团的名称是羧基.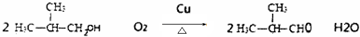 .
. .
.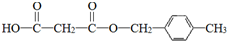 .
.查看答案和解析>>
科目: 来源: 题型:解答题
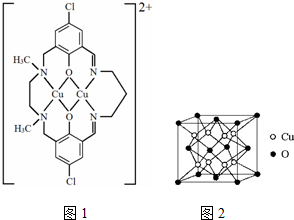
查看答案和解析>>
科目: 来源: 题型:解答题
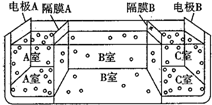
查看答案和解析>>
科目: 来源: 题型:选择题
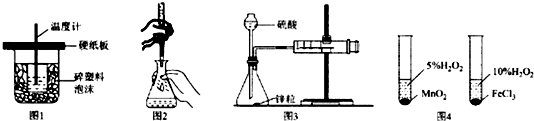
| A. | 图1装置用于中和热的测定 | |
| B. | 图2装置用于高锰酸钾溶液滴定草酸 | |
| C. | 图3装置用于测定氢气的反应速率(单位mL/s) | |
| D. | 图4装置用于研究不同催化剂对反应速率的影响 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
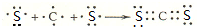 .
.查看答案和解析>>
科目: 来源: 题型:解答题
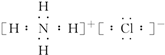 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com