
科目: 来源: 题型:选择题
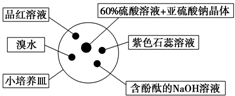 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
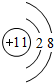 ,最活泼的非金属元素是F (填元素符号,下同),Ar是最不活泼的元素.
,最活泼的非金属元素是F (填元素符号,下同),Ar是最不活泼的元素.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有需要加热的反应都是吸热反应 | |
| B. | 所有金属元素形成的化合物都是离子化合物 | |
| C. | 所有主族元素的族序数等于其原子最外层上的电子数 | |
| D. | 所有共价化合物分子中每个原子最外层都达到稀有气体的稳定结构 |
查看答案和解析>>
科目: 来源: 题型:解答题
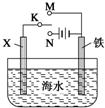 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.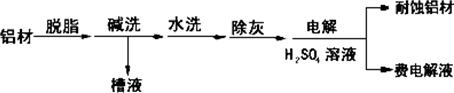
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 实验 编号 | 温度 /℃ | 平衡常数 /mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=2.4 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v(SO2)=0.2 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com