
科目: 来源: 题型:选择题
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
查看答案和解析>>
科目: 来源: 题型:多选题
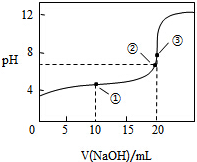 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是( )| A. | 点③溶液显碱性的原因是 CH3COO-+H2O═CH3COOH+OH- | |
| B. | 点②时溶液中c(Na+)大于c(CH3COO-) | |
| C. | 点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-) | |
| D. | 在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1Fe(NO3)3溶液. | 溶液变为红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴 3mol•L-1AgNO3溶液. | 现象a出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴 3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室要配制2mol/L稀硫酸250mL.
实验室要配制2mol/L稀硫酸250mL.查看答案和解析>>
科目: 来源: 题型:解答题
| 应称取氢氧化钠固体的质量/g | 应选用容量瓶的规格/mL | 除烧杯、托盘天平、容量瓶、量筒外还需的其它仪器 |
| 10.0 | 250 | 玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
科目: 来源: 题型:解答题
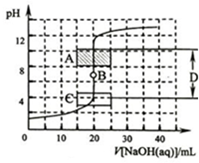 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.查看答案和解析>>
科目: 来源: 题型:填空题
 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目: 来源: 题型:解答题
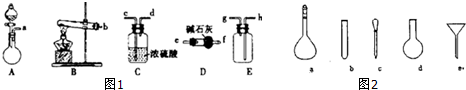
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com