
科目: 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | |
| C. | 随核电荷数递增,氢氧化物碱性增强 | |
| D. | 随电子层数增加,原子半径增大,金属还原性和金属性增强 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
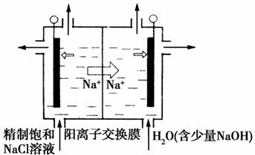 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
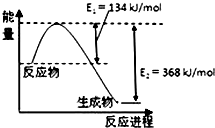 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目: 来源: 题型:选择题
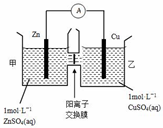
| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol/L KCl溶液 | B. | 自来水 | ||
| C. | 0.5mol/L盐酸 | D. | 0.5mol/L醋酸溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:查看答案和解析>>
科目: 来源: 题型:解答题

| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com